Aki atau yang biasa disebutt accu atau akumulator adalah salah satu jenis sumber tegangan listrik.
Istilah akkumulator berasal dari istilah asing “Accumuleren” yang mempunyai arti mengumpulkan atau menyimpan.
Istilah akkumulator berasal dari istilah asing “Accumuleren” yang mempunyai arti mengumpulkan atau menyimpan.
Akumulator (accu, aki) adalah sebuah alat yang dapat menyimpan
energi (umumnya energi listrik) dalam bentuk energi kimia. Contoh-contoh
akumulator adalah baterai dan kapasitor.
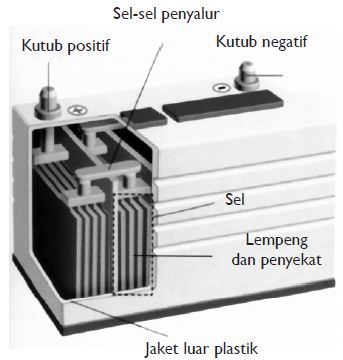
Kutub positif akumulator berupa lempeng-lempeng timbal peroksida berpori
dan kutub negatifnya berupa lempeng-lempeng timbel murni berpori. Kedua
lempengan kutub tersebut dimasukkan ke dalam larutan asam sulfat.
Setiap pasang lempeng kutub positif dan negatif disebut satu pasang sel yang dapat menghasilkan beda potensial sebesar 2 volt.
Sebuah aki biasanya terdiri atas beberapa sel untuk mendapatkan tegangan yang lebih besar. Misalnya, aki 6 volt terdiri atas 3 pasang sel dan aki 12 volt terdiri atas 6 pasang sel.
Pada aki terjadi perubahan energi, yaitu dari energi kimia menjadi energi listrik. Jika aki terus-menerus dipakai, energinya akan melemah.
Akibatnya, arus listrik yang mengalir akan mengecil, karena keping-keping pada sel dilapisi oleh timbel sulfat dan larutan asam sulfat di dalam aki semakin encer sehingga menghambat aliran elektron.
Setiap pasang lempeng kutub positif dan negatif disebut satu pasang sel yang dapat menghasilkan beda potensial sebesar 2 volt.
Sebuah aki biasanya terdiri atas beberapa sel untuk mendapatkan tegangan yang lebih besar. Misalnya, aki 6 volt terdiri atas 3 pasang sel dan aki 12 volt terdiri atas 6 pasang sel.
Pada aki terjadi perubahan energi, yaitu dari energi kimia menjadi energi listrik. Jika aki terus-menerus dipakai, energinya akan melemah.
Akibatnya, arus listrik yang mengalir akan mengecil, karena keping-keping pada sel dilapisi oleh timbel sulfat dan larutan asam sulfat di dalam aki semakin encer sehingga menghambat aliran elektron.
Cara Mengisi Ulang Aki
Akkumulator yang telah habis (kosong)
dapat diisi kembali, karena itulah akkumulator disebut juga dengan
elemen sekunder. Untuk melakukan pengisian diperlukan sumber tenaga
listrik arus searah lain yang memiliki beda potensial sedikit lebih
besar. Misalnya akku 6 volt kosong harus disetrum dengan sumber arus
yang tegangannya sedikit lebih besar dari 6 volt. Kutub positif sumber
tegangan dihubungkan dengan kutub positif akumulator, dan kutub negatif
sumber tegangan dihubungkan dengan kutub negatif akumulator. Dengan cara
tersebut elektron-elektron pada akumulator dipaksa kembali ke elektrode
akumulator semula, sehingga dapat membalik reaksi kimia pada kedua
elektrodenya.
Proses pengisian dapat berjalan dengan
baik apabila arus searah yang diberikan memiliki ripple yang cukup
tinggi untuk mempermudah proses kimia (pelepasan elektron) dalam
kepingan-kepingan elektroda. Selain itu, penggunaan arus pengisian yang
relatif kecil dengan waktu pengisian lama dapat diperoleh hasil
pengisian yang lebih baik dan memperpanjang umur pakai akkumulator.
Besarnya arus pengisian dapat diatur dengan reostat. Pada saat pengisian
terjadi penguapan asam sulfat, sehingga menambah kepekatan asam sulfat
dan permukaan asam sulfat turun. Oleh sebab itu, pada akumulator perlu
ditambahkan air murni (H2O) kembali. Reaksi kimia yang terjadi saat
akkumulator diisi adalah :
- Pada elektrolit : H2SO4 –> 2H+ + SO4 2–
- Pada anode : PbSO4 + SO4 2– + 2H2O –> PbO2 + 2H2SO4
- Pada katode : PbSO4 + 2H+ –> Pb + H2SO4
Jadi pada saat pengisian akkumulator,
pada prinsipnya mengubah kembali anode dan katode yang berupa timbal
sulfat (PbSO4) menjadi timbal dioksida (PbO2) dan timbal murni (Pb),
atau terjadi proses ” Tenaga listrik dari luar diubah menjadi tenaga
kimia listrik di dalam akkumulator dan kemudian disimpan di dalamnya.”
Dalam pembuatan akkumulator ada beberapa
hal yang harus diperhatikan pertama, bahan yang digunakan harus mudah
menggabungkan diri secara atomik atau molekuler dengan zat-zat kimia
lain atau dengan kata lain, yang mudah di-oxidir. Kedua, bahan tersebut harus mudah melepaskan lagi atom atau molekul oksigen yang telah menyatu dengannya, atau mudah di-reduksir. Ketiga
yang tidak kalah penting, bahan yang dipergunakan harus mudah didapat
di alam dan murah harganya. Pilihan akhirnya jatuh pada logam yang murah
dan mudah didapat di alam yaitu timbal (PbO ) dan timbal oksida (PbO2).
Dengan alasan-alasan itulah akkumulator (akku, aki, accu) dewasa ini
sangat populer digunakan dalam berbagai keperluan.